Jak bilansować równania redoks?
W jednym z zadań matur próbnych pojawiło się zadanie zawierające tzw. tlenek mieszany. Przykład ten pokazuje, jak można źle nauczyć się bilansu, bez zrozumienia teorii. Widzę, jak wielu nauczycieli w internecie próbuje błędnie opisywać algorytm rozwiązywania redoksów. Niektórzy nawet dowodzą, że można dokonywać bilansu bez szukania stopni utlenienia przed i po reakcji!
Pamiętajmy, że istotą reakcji utleniania redukcji jest właśnie zmiana stopnia utlenienia. Potencjał redukcji danego pierwiastka zależy zwykle od środowiska reakcji, co ewidentnie widać dla manganianu (VII) potasu, w 3 środowiskach są 3 różne produkty reakcji.
Teraz przejdźmy do przypadku związku Fe3O4, który reaguje w środowisku zasadowym.

Krok 1. Powinniśmy najpierw ustalić stopień utlenienia żelaza - ponieważ cząsteczka zawiera metal na różnych stopniach utlenienia, to najwygodniej obliczyć średni stopień utlenienia, który wynosi 8/3.
Uzasadnienie:
3x-4*(-2)=0
3x=8
x=3/8
Po reakcji natomiast jon żelazianowy ma żelazo na VI stopniu utlenienia - analogicznie do jonu siarczanowego (VI).
Krok 2. Ustalenie liczby wymienianych elektronów.
Mamy 3 atomy żelaza z wartością 8/3, czyli sumarycznie 8. Po reakcji natomiast jest 3*6 co daje 18. Różnica w naładowaniu tych 3 atomów wynosi 10 ładunków elementarnych. Zatem w równaniu piszemy +10e po stronie produktów.
Krok 3 bilans ładunku elektrycznego. Wymiana elektronów nie pozostaje bez wpływu na stan ładunku elektrycznego. W danym równaniu połówkowym musimy mieć zrównoważony ładunek. Przed reakcją mamy ładunek 0, a po reakcji są 3 aniony z wartością -2 oraz 10 elektronów (ujemnych!), więc razem -16. Potrzebujemy w substratach 16 jonów hydroksylowych.

Krok 4 Dodanie wody. Teraz dopiero widzimy, że woda będzie w liczbie 8 cząsteczek. Podejście nauczycieli, którzy najpierw ustalają wodę, a potem dobierają jony, jest nieprawidłowe i niedydaktyczne. Zresztą natknęłam się na pewnym kanale na youtube na osobę, która podczas tzw. live'a zarzuciła rozwiązanie takiego przykładu podesłanego przez ucznia.
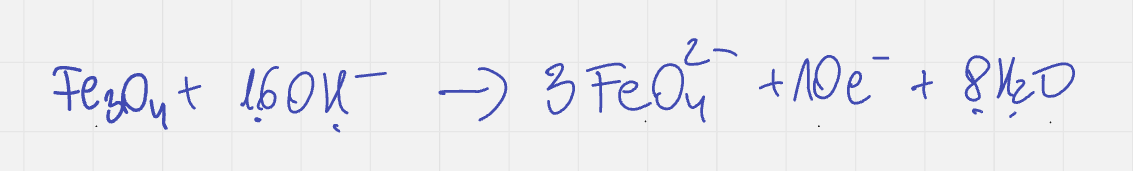
Nie mając informacji o 16 jonach OH- moglibyśmy próbować dawać 8 OH- bo widzimy 3 aniony żelazianowe z 12 atomami tlenu w produktach. 12-4=8, co dałoby zły wynik bilansu elektrycznego.
Krok 5 - działania powtarzamy dla drugiego równania połówkowego.
Krok 6 Mnożymy równania połówkowe -tutaj czynnik najmniejszej wspólnej wielokrotności wynosi 30, co przedstawia się:

Krok 7. Odejmujemy stronami nadmiarowe cząsteczki wody oraz aniony hydroksylowe.

Gotowe! Cieszymy się rozwiązanym przykładem i uzyskanymi punktami na egzaminie :)